生动细胞张豪:细胞治疗的自动化生产装备和耗材|嘉程流水席165席精彩回顾
02.24.2023
|
嘉程资本:创新者的第一笔钱
|
嘉程创业流水席
之前的经历使我发现整个细胞生产的从材料到设备几乎都以进口为主,所以我们希望能够在这个细分领域推进国产化,为客户提供自动化的生产工具和耗材,同时也跟客户一起合作,进行一些终产品的生产。

近日,嘉程创业流水席第165席【生物科技实验室自动化及仪器2023新趋势】,邀请了生动细胞的创始人张豪来分享,主题是《细胞治疗的自动化生产装备和耗材》
以下为正文部分:

今天很荣幸能有机会跟大家介绍一下我们生动细胞的产品,以及我们在自动化方面做的一些工作。我们公司专注在生命科学一个特定的细分领域,即细胞治疗及相关行业,所以我们做的自动化也是完全围绕着细胞治疗的自动化。所以今天我的介绍分为几个部分:细胞治疗的行业背景,以及细胞治疗的自动化,和普通实验室以及NGS等自动化的一些区别。
首先是细胞治疗的行业背景。因为生命科学的范围特别广,细胞治疗只是其中比较小的细分,属于生物制药的其中一种。在生物制药中,我们常听到的有小分子药物,比如说最近非常抢手的阿莫西林、退烧药布洛芬等,这种小分子药物都是在一千道尔顿分子量以内的,大家常规能看到的一些化学药片,都属于小分子化学药。但是随着生物制药的发展,药品逐渐从小分子药发展到大分子药,两者不光是分子量的巨大差异,差了近千倍,而且它们的结构也会有很大不同,相当于是自行车到汽车的结构巨大的变化。在大分子领域,早期的大分子是生长激素,到后期现在有比较多的单抗药物,甚至还有双抗等药物。细胞药物跟传统化学药的区别在于,细胞本身是一个活的成分,是我们人体的基本组成单位,大家如果看右上角的细胞,它已经不再用分子量来作为一个计量单位了,更多的是以尺寸来计量,并且细胞本身也是可以通过细胞培养来分泌产生大分子的。所以我打了一个比喻,认为可能单个细胞就相当于一艘航空母舰,可以装载上百架飞机,即上百个单抗分子。
细胞药物除了结构的复杂以外还有一个特点是,作为活的药物,它是无法进行终产品灭菌的。我们看到的小分子药或者单抗药,都有办法进行终产品灭菌,确保最终回到用户端,无论是回输或者口服的药物,是完全无菌的。但是因为细胞为了保持它本身的活性,在最终制剂的时候无法进行灭菌,所以整个细胞的生产需要更严格的无菌操作,这种严格程度比小分子和大分子更复杂。另外,因为细胞是活的药物,在运输和存储过程中,为了保持它的活性,几乎都需要冷冻保存,在使用时又必须再解冻,也几乎不能通过口服的方式,而是基本都采取注射的方式。正是因为细胞药物有这些特点,所以细胞药物的生产,跟传统的大分子和小分子会有非常大的区别。

细胞药物本身还有两种不同的类型。一种我们称之为悬浮细胞,悬浮细胞简单地说是在溶液中悬浮的可以生长的细胞,它不需要贴附在物体的表面,我们这里面会提到比较多的是血液当中的免疫细胞,当免疫细胞在血液中流动,就可以进行生长,免疫细胞又会细分到像Car-T细胞,以及CIK、自然杀伤细胞NK,还有TIL肿瘤浸润细胞、巨噬细胞等;贴壁细胞是指贴在物体表面才能够进行生长的细胞,人体中绝大多数的细胞都是贴壁细胞,目前在制药领域用的比较多的,有间充质干细胞,简称MSC,或者是iPSC诱导多能干细胞等。这种细胞的生产跟悬浮细胞比,最大的区别就在于,它必须不断地增加培养体积和面积,因为细胞在溶液当中的密度是有一个范围的,就相当于大家鱼缸中养鱼一样,鱼的数量和水的体积是一定关系的,水中的鱼不能太密,否则每条鱼都无法获得足够的营养,细胞也是一样,在培养细胞中,为了获得更多的细胞,我们需要不断地增加细胞的培养液,给细胞提供充分的养分。贴壁细胞不仅需要增加培养液,也需要增加表面积,因为细胞它只能贴在物体的表面,一旦贴满表面之后,就不能进行生长,必须去寻找新的物体表面。

刚才是讲的细胞本身的特性,目前全球的细胞治疗,截止到今年11月,全球活跃的免疫细胞治疗临床试验大概有1000多项。干细胞以MSC为例,大概有600多项,已经上市的免疫细胞有13项,MSC、间充质干细胞上市药物已经有14款。在沙利文的分析报告中,预计我国在2025年,细胞基因治疗,就是CGT的市场规模是大概在26亿美金左右。所以细胞治疗是一个在生物领域中新兴的细分市场。
并且细胞治疗,以其中刚才提到的悬浮细胞、免疫细胞为例,它才刚刚实现了从0到1的突破。因为全球首款的Car-T细胞治疗是2017年在美国上市的,到目前为止,多款Car-T细胞治疗累计销售额已经突破了18亿美金,预计全球销售额会在180亿美金左右。我国首款的Car-T细胞治疗在去年9月份才刚刚上市,截止到目前,我国一共也只有两款Car-T细胞治疗药物上市。这些Car-T细胞治疗公司,目前累计的融资金额已经突破了23亿美金。所以相对来说,是一个早期市场,但是有非常大的资本关注。另外市场规模预计在2025年,我国的Car-T细胞市场规模也会达到80亿元。除了刚才提到的自体Car-T,还有一种通用型Car-T。自体Car-T指的是生产的细胞只能给病人自己使用,通用型指的是可以由健康的捐献者捐献出的T细胞,经过处理之后给更多的病人使用。全球首款通用型的Car-T细胞,就在上周刚刚获批。所以总体来看,无论从我国还是全球来看,免疫细胞治疗都是刚刚实现了产业化,进入商业化的初始阶段,所以有巨大的发展空间。
这张PPT我们也把全球已获批的免疫细胞中的Car-Tar细胞药物列举了出来,目前一共是8款Car-T药物获批。我国一共是只有两款,分别是从美国引进的复星凯特和药明巨诺的Car-T药物。Car-T药物累计获批的八款,在全球的销售已经突破了18亿美金。Car-T药物的定价也相对比较高,基本上国外都在30-50万美金,我国的定价是120万人民币左右。

除了Car-T细胞以外,另外一大类贴壁细胞的代表是间充质干细胞MSC。以MSC为例,目前在我国发起新药申请临床实验的IND大概有27项,全球获批的间充质干细胞药物已经有14项,目前我国还没有获批的间充质干细胞药物。因为这个行业相对比较新,有很多新的问题和挑战。
生产方式方面,这里列举了一个Car-T的细胞生产流程,展示哪一些环节可以实现自动化,以及用模块化或者集成式的自动化。Car-T的工艺跟传统的大分子和小分子药最大的区别在于,首先它的起始物料是来自于病人自己的血液,从病人那里采集血液之后,需要从血液当中分离出单个的核细胞,简称PBMC,从这些细胞当中选出负极特定的细胞亚型,把这些亚型的细胞再经过激活或者基因编辑改造之后,使它能够靶向特定的肿瘤细胞,再进行放大生产。之后,经过洗涤分装做成制剂,再冻存、经过质检后运输到医院,在医院解冻复苏,再回溯到体内。所以它整个的生产工艺流程是比较复杂的,从采血到最终回输,最短的要半个月,长的要一个多月。
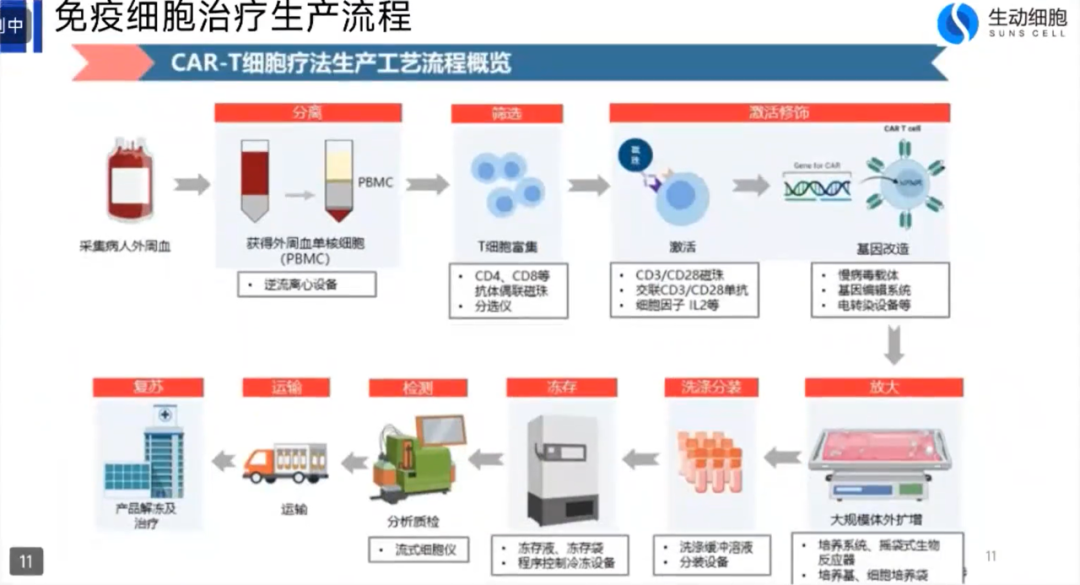
目前常见的Car-T生产工艺,很多是从科研环节衍生而来,科研环节生产细胞比较多的是用手工操作。刚刚提到,所有的细胞药瓶都无法进行终端灭菌,所以它的生产环境要求比较高的洁净等级。像这张照片左上角展示的是比较昂贵的GMP的B+A级洁净环境,B+A级简单理解就是操作人员所在的环境是GMP的B级,类似于一个千级的车间,所有的细胞操作必须在一个A级的环境,就是在生物安全柜里面或者无菌隔离器里面进行操作。大的生产环境的建造成本非常高,GMP C级万级车间的建造成本大概在每平米1万人民币左右,B级车间是C级车间的数倍以上,C级车间的维护成本也非常高,每年每平米接近1000元。所以,一个仅仅为200人进行Car-T细胞制备的生产车间,都需要大概500-700平米的GMP车间,大家可以算一下,车间的建造成本和维护成本都是以千万级别来计算。
除了昂贵的生产环境以外,传统的手工生产主要使用的设备是大家右边看到的,像梯度离心使用的离心机,配套耗材是离心管,接下来是细胞分选用的磁力架。培养端这个环节花的时间相对比较长,就会用到培养箱,它的耗材就是培养瓶或者培养袋。到离心洗涤又继续会用到原有的离心机,到最后一步分装又会用传统的移液枪手工进行移液操作,把细胞最终分到右下角的冻存管里面。整个过程几乎都是完全手工操作,所以每一个容器都有一个开盖的操作,无论是离心瓶、培养瓶还是共存管,由于开盖操作会有比较大的污染风险,所以必须要在无菌隔离器或者是GMP B级车间里面的生物安全柜的A级环境中进行。

目前细胞治疗的自动化方向,80%以上都是模块式自动化。模块的自动化指的是在每一个操作环节、每一个工艺过程中,会有不同厂家提供的仪器来代替传统的手工操作。举个例子,在离心这个环节,代替传统离心机的是这种活塞式离心机,在磁炉分选中代替磁力架和手工操作的又是进口的磁力分选仪,在培养阶段,代替培养箱的是波浪式的生物反应器。模块式的生产除了每一个环节的仪器进行了变更以外,耗材也进行了巨大的改变。比如说离心环节中的离心筒跟普通的离心管已经完全不一样;细胞培养使用的一次性生物工艺袋和培养瓶相比也更复杂,因为细胞培养袋可以焊接到一次性的传感器,配合生物传感器就能实时监控细胞培养环节中的温度、PH值、溶解氧等参数,而且能够进行像灌流等复杂的操作。所以这种模块化会根据每一个环节,有一款独立的仪器来替代传统的手工操作,到后面的操作也都会有对应的配套仪器,比如进行耗材焊接的无菌接管机;模块式耗材的核心理念在于,几乎所有传统的这种瓶式耗材,都换成了这种柔性的袋式耗材,袋式耗材的好处是其管道可以由无菌接管机进行焊接,同时袋式耗材的体积更容易放大,可以从最小的几毫升放大到上千升,硬塑料的离心瓶放大相对会比较复杂,常见的都可能只能在几毫升到几百毫升或者一升以内,很少做到几十升或上千升。
用模块式的生产设备另外一个优点,是因为封闭的耗材,整个生产环境就不用担心开盖操作的污染,所以生产环境可以降低到一个GMP C级或者D级车间,GMP D级车间的建造成本只有C级车间的一半,维护成本也是极大地减少。模块化自动化跟手工操作还有一些区别,除了前端的离心和培养换成的打离心机,培养箱换成的活塞离心筒和生物反应器以外,在模块式的生产过程中,在下游的环节,比如细胞的分装环节,也是替换了传统的手工移液枪,使用自动化的冷冻分装系统,细胞也不冻存在离心管中,而是储存在袋式的冻存袋中,在解冻复苏环节也不再用传统的水浴锅去解冻离心管,而是用专门的仪器去解冻冻存袋,因为冻存袋的体积相对离心管来说会更大,并且冻存袋是一个封闭体系,用这种仪器式的解冻复苏,整个解冻的时间会更快、污染的风险会更小。

免疫细胞的生产,除了刚才介绍的模块自动化以外,还有一种是集成式自动化。目前市场上现有的两种集成式自动化设备,主要解决了前面三个环节,即离心分离、雌株分选和细胞培养三个环节,把这三个环节集成在一台仪器上。但是接下来的无菌接管、分装和解冻复苏,还是要用模块式的仪器。集成式仪器的好处在于整个环节更加封闭、更加自动化,不需要手工再进行不同环节耗材的焊接。但是它目前是根据工艺来设计的,所以现有的处理级都是在100-1000毫升,比较适合自体细胞治疗,而对通用型细胞治疗则需要生产10-50升以上的细胞,这个设备体积就会比较小,无法满足通用型细胞治疗的需求。
刚才我介绍的是悬浮细胞生产,现在再举一个贴壁细胞生产工艺的例子。刚才提到,贴壁细胞跟悬浮细胞最大的区别在于它不仅需要培养基的体积增加,还需要不断增加物体的表面,使细胞可以贴在表面上进行生长。传统的放大方式是通过培养瓶加手工生产,培养瓶由左上角的图片展示的这种细胞培养瓶 T75瓶,配合培养箱,T75瓶的底面积大概在75平方厘米,每平方厘米最多可以培养一万个细胞所以这样一个瓶子最多能够培养不到100万个细胞,但是传统的像间充质干细胞治疗,它的用量是需要每公斤体重配接近200万个细胞,这样来计算,一个70公斤体重的病人就需要大概140个T75瓶,基本上要塞满两个培养箱。另外一种解决方法就是提供使用多层的细胞工厂,多层细胞工厂只是把培养瓶从单层的底面变成了一个多层,最多可以做到40层,但是一个10层的细胞工厂底面积也只有800多平方厘米,所以做一个病人的细胞,仍然需要12个细胞工厂,这样无法放进培养箱,就必须使用右上角的这种恒温室。但整个操作中,还是需要工作人员进入恒温室,也要求GMP的B级车间。

贴壁细胞的另外一种自动化可以也称之为全自动化,是用机械臂来替代人工,由机械臂集成培养箱、离心机、显微镜等,完全模拟人手的操作,不改变细胞培养使用的材料和工艺。单个机器每天可操作大概100多个T125瓶,这个目前现有的市场上供应商还比较少,例如德国的赛多利斯Compact,国内也只有两三家公司也能提供类似的产品。机械臂的优点在于整个过程的全自动化,但它的挑战在于是否能不出错、是否能够节省生产成本,因为机械臂式的工作站相对造价就非常高。
除了机械臂的自动化,另外一种自动化方式就需要改变细胞培养的材料,从细胞培养瓶转变成其他的,比如说细胞培养的微球载体。细胞贴附在一个物体表面,贴壁生长有四个过程,基本上要通过静电吸附、细胞接触、细胞附着和细胞再生长,所以如果要实现自动化,另外一种方式就是改变培养容器,把细胞培养瓶换成细胞培养的微球载体。比如我们生动细胞生产的明胶微球载体,大概在200微米左右的微球,左下角的第一幅图是细胞和微球接触一个小时的时候的显微镜照片,比较大的圆形颗粒就是微球,非常小的小点就是细胞,在刚接触的时候细胞是没有伸展开的,所以它只是通过静电吸附在微球的表面。接触18个小时之后,细胞几乎伸展开,所以在光滑微球表面我们能大概看到一些梭形的痕迹,这就是伸展开的细胞。所以通过改变细胞培养的材料,我们就可以实现用相对简单的自动化方式来放大细胞生产。

在细胞贴在微球之后,可以通过搅拌瓶不断地去放大,让不同的微球载体悬浮在溶液当中,再去放大培养体积,培养体积是可以从搅拌瓶开始放大到波浪式生物反应器,再放大到3D的搅拌式生物反应器。微球使用了一种比较小的微米级别的材料,所以它的比表面积远远大于传统的培养品,一克微球的比表面积是3200多平方厘米,相当于4个细胞工厂,所以刚才讲的一个病人需要4个细胞工厂,转换成微球只需要3克微球,在医生的培养基中就可以生产了,所以这个时候我们如果要生产2000个病人用量的细胞,用一个2000升的生物培养基就足够了,但如果用细胞工厂几乎是需要24000个细胞工厂,或者28万个传统培养品。所以微球载体通过改变材料的方式可以极大的节省人工操作,更加方便实行自动化。
除了微球载体以外,市场上目前还有一种纸片载体,跟微球载体的区别就在于材料的不同。微球载体200微米左右,纸片载体大概是三厘米左右的圆形,同时市场上也有折叠式的纸片载体,纸片载体也是配生物反应器来替代培养箱,实现细胞的自动化生产。纸片载体贴附上的细胞相对微球载体更难消化,因为纸片载体表面有非常多的纤维,细胞贴上去会非常牢靠比较适用于不需要收获细胞的生产,比如说灭活病毒疫苗等,所以在动物疫苗灭活疫苗的生产中会大规模使用到纸片载体,但是在人用疫苗的时候,比如说现在我们使用Vero细胞的新冠疫苗,还是用微球载体生产的多。
这里也介绍一下我们生动细胞所做的工作。生动细胞的团队主要集中在细胞处理的材料和自动化中,我本人是在武汉大学和英国牛津大学研究生物材料,主要研究细胞培养的各种微球和药物缓释的微球,博士后我是在英国再生医学中心,主要研究不同的生物反应器和细胞工作站。有了这些经历之后,我们发现整个细胞生产的从材料到设备几乎都以进口为主,所以我们希望能够在细分领域推进国产化。因此,生动细胞的产品主要集中在细胞生产环节的各类设备和对应的耗材上,比如贴壁细胞生产使用的细胞培养瓶、配套的磁力搅拌器,以及波浪式生物反应器的,除了这些设备以外,我们也配套一些对应的耗材,比如对应的一次性工艺袋、微球载体等,这些产品目前也在客户端进行试用和销售了。配套的耗材微球产品,主要有不同材料生产的微球,比如葡聚糖微球,它主要用于疫苗的生产,明胶微球主要是用于收获细胞的,我们还生产了聚乳酸材料的实心或者多孔微球,用于需要更大比表面积的场景。
生动细胞公司的商业模式是为细胞治疗,尤其是免疫细胞、贴壁细胞,提供生产所需的装备,比如生物反应器、混匀分装复苏仪等,以及配套的耗材,比如一次性的生物工艺袋、维修载体等,也提供相关的一些生产型服务。除了销售这些生产工具和耗材以外,我们也提供部分的终产品,以微球载体和反应器为特点,利用细胞大规模的培养生产一些新型的细胞培养终产物,比如化妆品原料中使用的植物愈伤组织提取物、脐带提取物、MSC外泌体等。同时我们也在开发一些食品级的产品,比如说细胞肉、人乳蛋白等,以及培养基添加物,像血小板电解液等。整体我们是希望能够为客户提供自动化的生产工具和耗材,同时也跟客户一起合作,来进行一些终产品的生产。
席友:请问细胞生产器的微球,在后期的细胞培养完之后的洗脱,怎么把活体细胞完整或者有效地再分离出去?
张豪:如何洗脱细胞这个问题,取决于我们使用的微球载体。比如说葡聚糖微球,这种微球它本身是不可以完全溶解的、不可以降解的,所以需要通过传统的胰酶来消化细胞,把细胞从微球表面消化掉,消化掉之后,我们有专门的耗材,即带筛网的过滤袋,这种筛网的孔径大概在200微米,可以把微球完全挡在筛网上,所以就通过筛网收获细胞上清液,这是不可溶解微球的收获方式。另外一种是,微球本身是可以溶解掉的,比如说明胶微球,在细胞长在微球表面之后,可以加一种特定的酶,把微球完全溶解掉,这个时候收获的溶液当中就只有细胞,不需要去考虑如何分离微球和细胞。
席友:首先非常赞赏贵团队用这种增加表面积的微球的方式,如果用同样的、类似的流程,是否可以对细菌类的进行工艺操作?尤其是我们的团队面临着对厌氧菌的一些培养,是否也可以用类似的,或者直接转用你们的这种技术来帮助细菌类的培养?
张豪:我们还没有使用过厌氧,但我想可能用多孔微球,会对厌氧菌的生产比较好,因为我们可以生产这种普通表面多孔或者是贯穿式多孔的微球。贯穿式多孔可能它内部的氧浓度会更低,更适合厌氧菌贴附在表面进行生产,尤其是这种多孔结构,它的比表面积更大,也会增加细菌附着的表面,提高细菌的单位体积中的细菌密度。所以李总,这个接下来我们可以深度再交流一下,看看可以合作。
席友:目前贵司的细胞培养设备的功能?如是否可以做灌流最小的培养体积等信息。
张豪:细胞培养设备我们现在是有两款。一款是磁力搅拌的,只适合配合微载体,这种搅拌瓶目前还没有灌流,但它的培养体积最小从5毫升,最大到3升,是可以在培养箱中使用的。另外一种是波浪式的生物反应器,配合一次性的反应带,可以直接培养悬浮细胞,最小的培养体积是30毫升,最大的是50升,这个设备我们目前灌流功能正在开发当中,配合一次性反应带中添加的细胞肌瘤膜。
席友:使用纳米微球生产同批量的细胞,成本上有多大节约?未来和现有的培养是替代性关系,还是互补性关系?
张豪:从成本上来说,根据我们现在测算,如果用国产化微球之后,给定国产微球的定价大概在进口的2/3左右,整体来看生产成本是下降的。主要下降在于,节省了生产车间的面积以及人工。第二个问题,我们认为,对于传统的生产不是一个完全替代,而是一个升级,这个主要看客户的生产需求,贴壁细胞以培养细胞工厂为例,如果整个生产的需求只是在50升以内或者100升以内,用10个或者20个多层细胞工厂就可以了,就不需要用微球载体来放大,但是如果最终的生产需求在500升以上,我们认为微球载体会有更多优势。
席友:您的产品和耗材是用于干细胞公司比较多呢?还是医院比较多?感觉现在的应用是不是市场不够大?
张豪:干细胞只是微球耗材目前应用市场的其中一种,相对来说也是一个比较新的应用场景,在这个环节里进口和国产微球都在一个起跑线上,因为刚才说过干细胞药物还没有获批,所以都是行业开拓或者起步的阶段。更大的微球应用场景是疫苗的生产,比如说新冠疫苗或者其他的灭活疫苗——狂犬疫苗、禽流感、口蹄疫等,这种人用或者兽用疫苗的生产已经广泛地使用微球载体了,但这个市场是一个存量的进口替代市场。所以医院的客户相对还比较少,主要是生物工艺生产的企业客户。
席友:就这个问题我想补充请教一下,做国产替代的难度有多高?如果做国产替代会比较关注哪些点呢?
张豪:国产替代主要是在人用和兽用疫苗行业,而疫苗行业本身进入壁垒就非常高,因为已经广泛使用的进口产品基本上都有获批的产品,获批之后,微球是其中的一个核心生产原材料,如果想改变核心生产原材料,难度是非常大的,周期也比较长,可能客户需要花一年多的时间来进行工艺变更的申报,所以我认为难度最大的是跟客户合作,进行工艺变更申报。虽然疫苗是最大的市场,但我们前期会从间充质干细胞切入,因为干细胞是一个新兴市场,进口跟国产在一个起跑线上,替换会更容易一些。
席友:微球材料的安全性评价指标现在有哪些?如果应用于临床,从安全性考虑需要注意哪些事项?
张豪:因为微球材料取决于要生产什么样的产品,如果是生产细胞分泌产物型的,比如灭活病毒或者疫苗,它主要的是需要的是上清,这个时候微球作为一个药用辅料,主要考虑的是微球对细胞扩增或者产量的影响以及微球在产品中的残留,所以要测的主要是在中产品里微球的残留。如果是不可溶解微球,相对来说比较简单,如果是可溶解微球,就要测溶解之后的化学成分在最终产品中的残留度,这个也是可以通过多次洗涤,最终几乎完全去除溶解成分的。

嘉程资本Next Capital是一家专注科技领域的早期投资基金,我们极度信仰科技驱动的行业创新,希望成为创新者的第一笔钱,与极具潜力的未来商业领袖共同开启创新的未来。
我们的投资领域涵盖新消费、新技术、新医疗。投资案例包括熊猫速汇、多抓鱼、十荟团、拉面说、店匠、bosie、熊猫星厨、核桃编程、橄榄枝健康等多家创业公司的天使轮或早期阶段。
嘉程资本旗下的创投服务平台「嘉程创业流水席」,致力于为科技互联网创业者和行业人士提供深度链接和一手行业信息,迄今已服务数万名创业者,汇聚了数百个创业者社群,有近千位企业家与行业专家在嘉程创业流水席分享过行业观点。
嘉程资本创始合伙人李黎是知名天使投资人,曾主导投资过乐信(纳斯达克代码:LX)、团车(纳斯达克代码:TC)、老虎证券(纳斯达克代码:TIGR)、牛股王、蜜芽、辣妈帮、PingCAP、易订货、彩贝壳、鹿客、Krazybee等明星公司的天使轮。
嘉程资本是创业者思考的伙伴,成长的伙伴。
嘉程资本
握手未来商业领袖
BP 请发送至 BP@jiachengcap.com
微信ID:NextCap2017




